近日,pc加拿大预测准确率王海滨教授课题组、药学院吕忠显教授课题组联合在《自然∙通讯》(Nature Communications)杂志上发表重要研究成果,揭示了表观遗传修饰相关蛋白Menin通过组蛋白修饰调控子宫内膜基质蜕膜化的新机制,为女性不孕的治疗提供了潜在治疗靶点。
高度程序化的子宫内膜-蜕膜转化是哺乳动物早期妊娠过程中的一个关键事件,子宫内膜基质细胞通过复杂的分子重编程,特化为在形态和功能上截然不同的分泌型蜕膜细胞,为胚胎和胎盘的发育提供必要的营养物质和免疫豁免微环境。蜕膜转化伴随植入后胚胎的发育,并呈现出有序的区域化特性,受到雌、孕激素以及子宫组织中程序性表达分子的精密调控。然而,驱动蜕膜化相关分子时空特异性表达的机制在很大程度上仍然是未知的。
近年来,H3K4甲基转移酶复合体MLL1/2-COMPASS中的特异性亚基Menin已被证明能够通过H3K4me3改变启动子附近的染色质状态,参与调控相关基因的转录激活,但是关于Menin在早期妊娠过程中的作用仍未见报道。
王海滨教授率领的团队通过构建母体子宫特异性敲除Menin的小鼠模型,发现子宫Menin的缺失导致雌性小鼠生育力显著降低,在妊娠中期出现胚胎的流产现象。进一步的表型分析发现Menin敲除小鼠妊娠失败主要是由于妊娠维持中蜕膜发育的缺陷。转录组测序数据显示子宫特异性敲除Men1(Menin编码基因)的小鼠蜕膜组织中,异常激活的FGF2-ERK1/2信号对Bmp2表达的抑制是导致基质细胞蜕膜发育分化不足的主要原因。在分子机制上,Menin在染色质上的分布调控了蜕膜化相关基因启动子处的H3K4me3修饰。结合转录组的数据发现,此前未引起重视的分泌蛋白PTX3,作为胞外基质中FGF2蛋白的天然抑制剂,是Menin-H3K4me3直接调控的下游靶基因。在蜕膜化过程中, PTX3能够抑制来自未分化基质细胞层的FGF2,防止FGF2以旁分泌的形式激活次级蜕膜区中的ERK1/2,保证Bmp2在蜕膜分化区域的稳定表达。
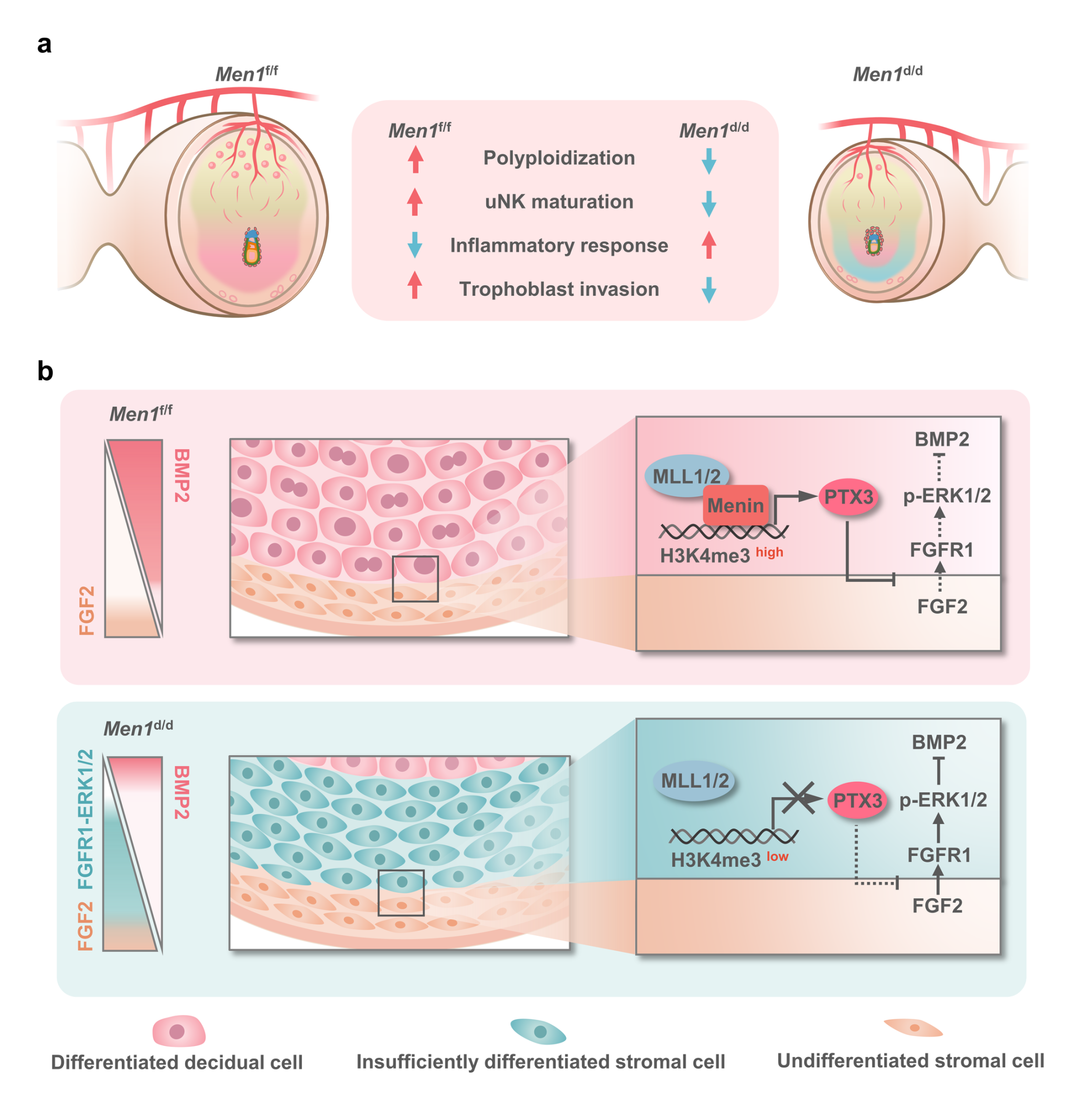
图1:Menin在蜕膜化过程中的功能示意图
以上结果多层次的阐明了Menin通过H3K4me3修饰调控下游关键分子的时空特应性表达,精确平衡基质细胞增殖信号与分化信号之间的互作,对于蜕膜化中内膜床不同区域之间的错误信号交流起到关键的制约作用,从而保证内膜-蜕膜有序的区域性转化,揭示了一个新的调控蜕膜区域化发育特性的分子机制,为更好阐释胚胎植入和蜕膜发育稳态失衡诱发生殖障碍的分子机理提供了新思路,也为女性不孕的治疗提供了潜在治疗靶点。
相关成果“Menin directs regionalized decidual transformation through epigenetically setting PTX3 to balance FGF and BMP signaling”2月22日在线发表在Nature子刊“Nature Communications”杂志,药学院2018级博士研究生刘梦莹和医学院邓文波教授为共同第一作者,通讯作者是医学院王海滨教授、孔双博副教授和药学院吕忠显教授。
原文链接:https://www.nature.com/articles/s41467-022-28657-2#Sec27。
(医学院王海滨教授课题组)


