
2021年7月29日,pc加拿大预测准确率/细胞应激生物学国家重点实验室-许韧教授课题组与美国康奈尔大学威尔医学院病理学系-Matthew Greenblatt教授实验室合作在《Nature Communications》上发表题为“SLITRK5 is a negative regulator of hedgehog signaling in osteoblasts”的研究论文,首次报道了一种成骨细胞特异性的Hedgehog信号分子开关-SLITRK5,可以有效的调节机体成骨活性与稳态,具有重要的临床开发潜能。
骨骼的生长发育和稳态主要涉及到两大细胞类型的功能:一是间充质干细胞来源的成骨干细胞,负责形成新的骨组织;二是造血干细胞来源的破骨细胞,负责吸收旧的骨组织。目前,临床上改善骨骼功能的药物大多数为破骨细胞相关的骨吸收抑制类药物,促骨形成药物的研发“瓶颈”急需新的策略与机制来有效解决。
外源Hedgehog信号对于机体骨形成与骨量累积至关重要,然而在成骨细胞中感应和调控hedgehog信号的细节机制还有待进一步解明。许韧教授的一系列前期工作证明:神经轴突化学导向因子在成骨细胞中高度表达,以自分泌和旁分泌的形式在骨稳态中发挥重要的生理学功能。本项研究便聚焦于一种新型的神经化学导向因子-SLITRK5,发现其在成骨细胞中特异性表达,并作为hedgehog信号的负调控因子来影响机体的成骨活性。体外缺失SLITRK5导致hedgehog信号通路增强,成骨细胞中过表达SLITRK5抑制hedgehog信号下游靶点的输出。在机制上SLITRK5定位于初级纤毛中,通过其胞外结构域与hedgehog配体结合,并通过其胞内结构域与受体PTCH1相互作用;SLITRK5的缺失增强了hedgehog信号刺激下SMO蛋白在纤毛的富集,促进机体骨折的愈合。因此,SLITRK5作为成骨细胞中特异的hedgehog信号负调控因子,是一种临床潜能可期,具有开发价值的骨科疾患治疗靶点。
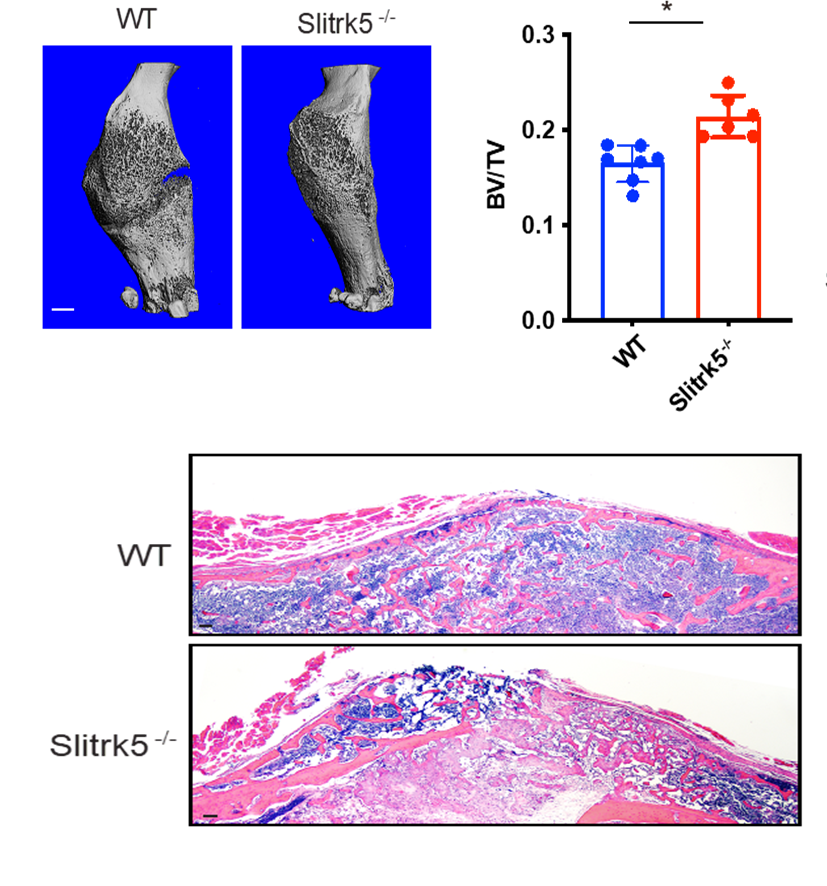
图 SLITK5敲除促进机体的骨折愈合
该项研究工作得到了科技部-国家重点研发计划、国家自然科学基金-重大研究计划、面上项目以及厦门大学“南强青年拔尖A类人才”基金的资助,与美国康奈尔大学病理学系、神经学系和特种外科医院共同合作完成。厦门大学许韧教授和康奈尔大学的Matthew Greenblatt教授为本文的共同通讯作者,厦门大学生命科学学院的李娜博士后也参与了此项工作。

许韧教授长期从事骨形成机制及其关联疾病的研究工作,现为美国、日本骨代谢学会会员、国际华人骨研学会终身会员、《Bone》和《Frontiers in Physiology》等期刊编委;以第一/通讯作者发表论文于《Nature》、《Nature Medicine》、《Nature Communications》和《Bone Research》等权威期刊。作为负责人,建立了厦门大学生物硬组织分析平台,主持国家高层次青年人才(QQ)、国自然重大研究计划(培育)、国自然面上、国家重点研发计划-干细胞转化课题等国家级基金项目。许韧课题组现因工作需要,热忱欢迎优秀博士后加盟,同时也欢迎广大学子报考pc加拿大预测准确率研究生。联系方式:xuren526@xmu.edu.cn
论文链接:https://www.nature.com/articles/s41467-021-24819-w
(许韧教授团队)


