近日,医学院眼科研究所楚成超副教授和公共卫生学院刘刚教授合作在化学领域国际顶级期刊Angew Chem Int Edit在线刊发了题为“Ru-based Metal-Organic Nanoradiosensitizers Enhance Radiotherapy by Combining ROS Generation and CO Gas Release”的研究成果。

放疗是治疗实体瘤最有效的局部深层治疗方式之一,主要通过直接高能电离辐射和间接的辐射水解产生的活性氧(ROS)破坏细胞DNA。但是,由于缺乏精确靶向性和放射敏感性,其临床应用受到一定限制;此外,ROS寿命短和作用半径小,使治疗效果也大打折扣。因此,改善放疗靶向性和放射敏感性,是临床放疗领域的关键难题和研究热点。
本课题研发了一种基于钌的金属-有机纳米结构放疗增敏剂(ZrRuMn-MONs@mem),通过在X射线诱导的动力学疗法(XDT)中最大化ROS的产生和一氧化碳(CO)治疗气体的释放来优化放疗。此外,随着CO的释放,MRI成像性能也得到显著增强,实现诊疗一体化效果的提高(图1)。
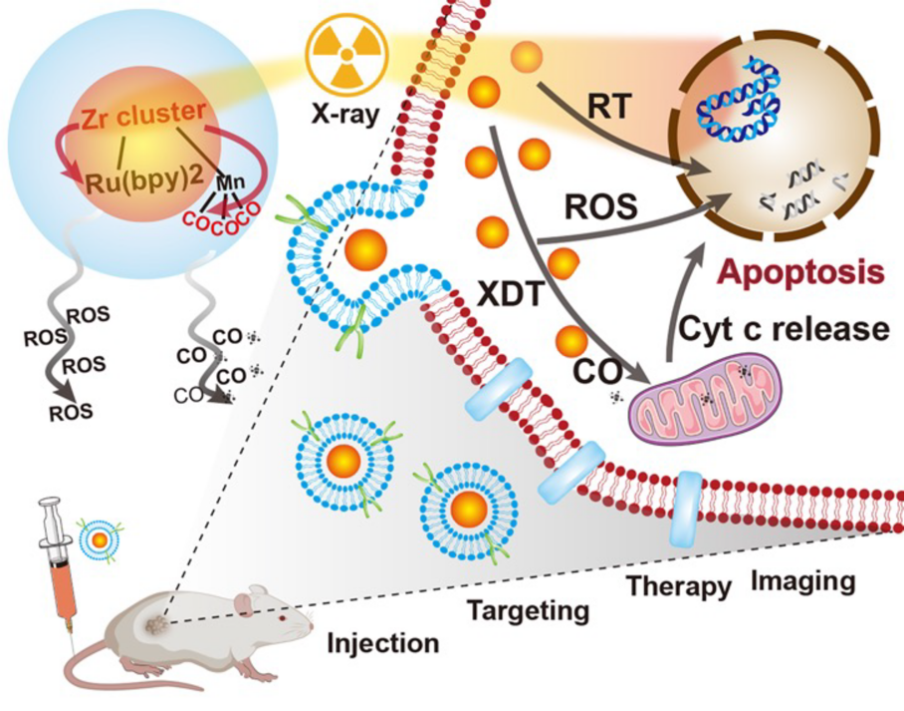
图1 ZrRuMn-MONs@mem 诊疗一体化策略流程图
在本研究中,钌金属有机纳米结构在放疗增敏方面显示出独特的优势。首先,高Z元素的存在,大大提升了对X射线的吸收,从而提高ROS的产生能力;其次,特殊的金属有机纳米结构能够通过有机配体实现能量和电子传递,从而提高放射动力学疗法的效率;此外,限域的空间结构在限制和传导中发挥重要作用,增加了激发态的电子与基态电子碰撞机会,并减少电子的损失。
研究团队将该放疗增敏剂类比为一个火球,能够实现ROS和CO在癌症诊疗方面的协同增强:当被X射线“击中”时,“火球”被点燃而激活,伴随着ROS的产生;当遇到体内水分子时,燃烧的火球逐渐被扑灭,不完全燃烧导致CO释放;当火球被水分子围攻后可导致T1加权的MRI成像性能增强,加上该金属纳米结构固有的CT对比剂性能,实现了成像指导下的精准放疗(图2)。
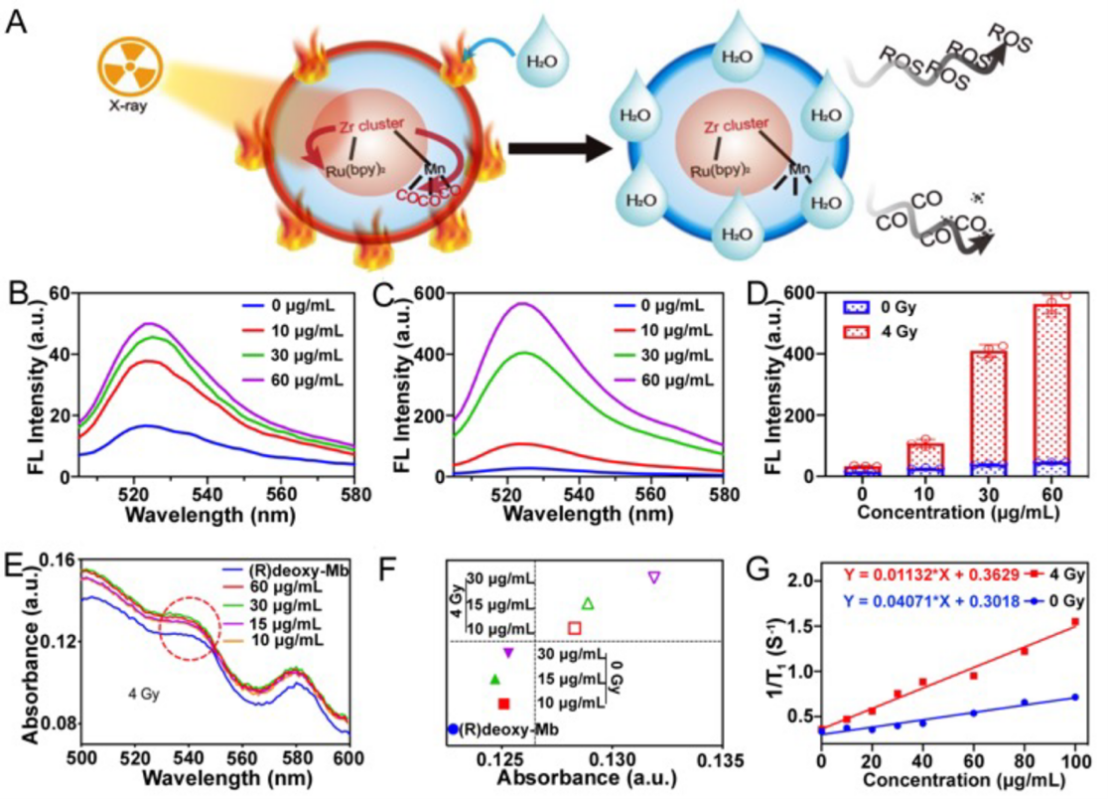
图2 ZrRuMn-MONs 在X射线激发下产生ROS和CO效果研究
当静脉注射给药后,靶向细胞包被的金属-有机纳米放疗增敏剂可以很好的富集在肿瘤部位;在给予适量辐照后,肿瘤部位的MRI成像也大大增强(图3)。
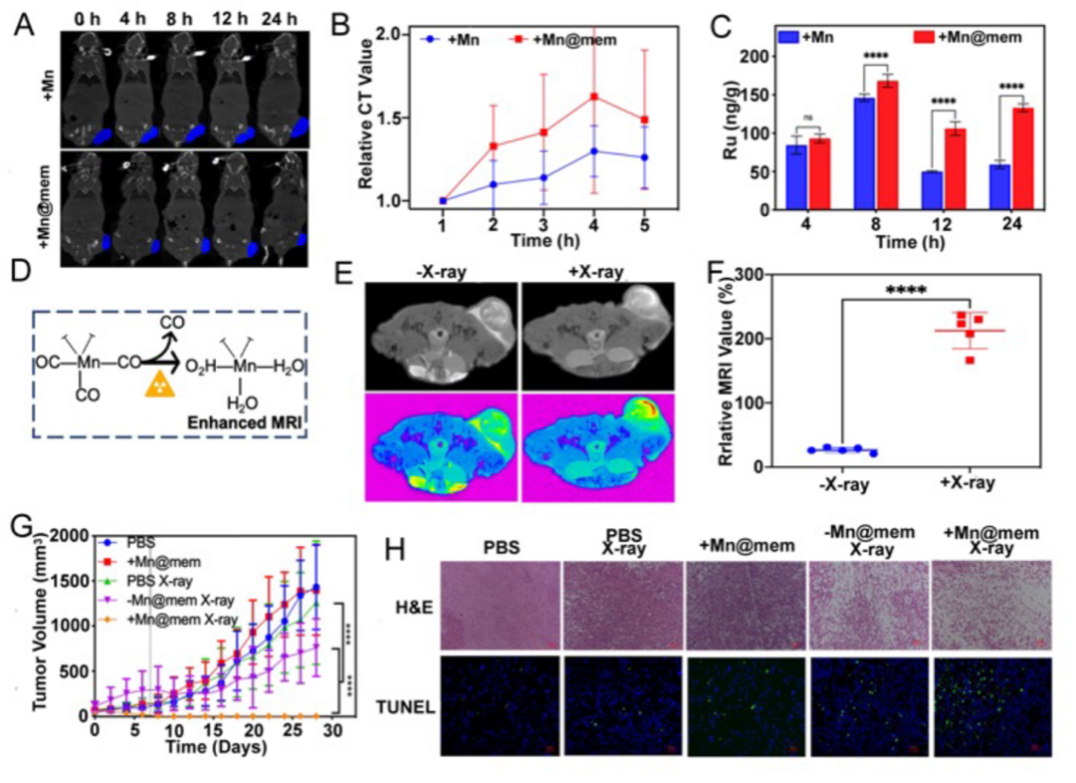
图3 ZrRuMn-MONs@mem 在肝癌诊疗方面的研究
总之,多功能放疗增敏剂ZrRuMn-MON@mem通过增加对辐射剂量的直接吸收(初级辐射)和促进光子和电子的沉积(次级辐射),实现ROS和CO的联合治疗。个性化的靶向细胞膜表面修饰改善了生物相容性和生物利用度,具有良好的转化应用前景。
楚成超副教授和刘刚教授为本文共同通讯作者。楚成超副教授是福建省高层次人才,厦门大学南强青年拔尖B类人才,博士生导师。他的课题组致力于超分子组装药剂的研发及应用研究,以第一作者/通讯作者在Adv Mater、Angew Chem Int Edit、Adv Funct Mater、Adv Sci、Theranostics等高水平学术期刊发表论文40余篇。目前主持国家自然科学基金面上项目和青年项目、福建省自然科学基金面上项目、校南强计划支持项目等多个科研项目。楚成超副教授课题组因工作需要,热忱欢迎优秀博士后加盟,同时欢迎优秀学子报考课题组博士研究生、硕士研究生。联系方式:chuchengchao@xmu.edu.cn。
原文链接:https://doi.org/10.1002/anie.202211674
(图文/楚成超 审核/李炜)


