近日,抗癌研究中心刘欢教授课题组与附属第一医院方志鸿副教授合作在探索骨髓瘤细胞诱导溶骨性骨损伤分子机制方向取得新进展,相关工作成果以题为“m6A reader hnRNPA2B1 drives multiple myeloma osteolytic bone disease”发表于《Theranostics》。

多发性骨髓瘤(Multiple Myeloma)是一种发源于血液系统浆细胞的恶性肿瘤,超过80%的患者会产生骨损伤,并伴随骨痛或骨折,严重降低患者的身体机能、生活质量甚至危及生命。骨损伤主要原因是调控溶骨的破骨细胞功能过度激活和调控新骨形成的成骨细胞功能过度抑制,但是目前分子机制仍然不清楚。近年来,刘欢教授团队致力于解析骨髓瘤诱发溶骨性骨损伤的分子机制以及靶向治疗的转化医学研究,发现了多个骨损伤治疗的新靶点(Science Translational Medicine, 2016, 2019; Nature Communications, 2022; Science Signaling, 2017, 2020; Frontiers in Oncology, 2021; Journal of Translational Medicine, 2022)。这些发现对于治疗其他骨转移性肿瘤比如乳腺癌、肺癌、肝癌等引起的骨损伤同样具有重要指导意义。
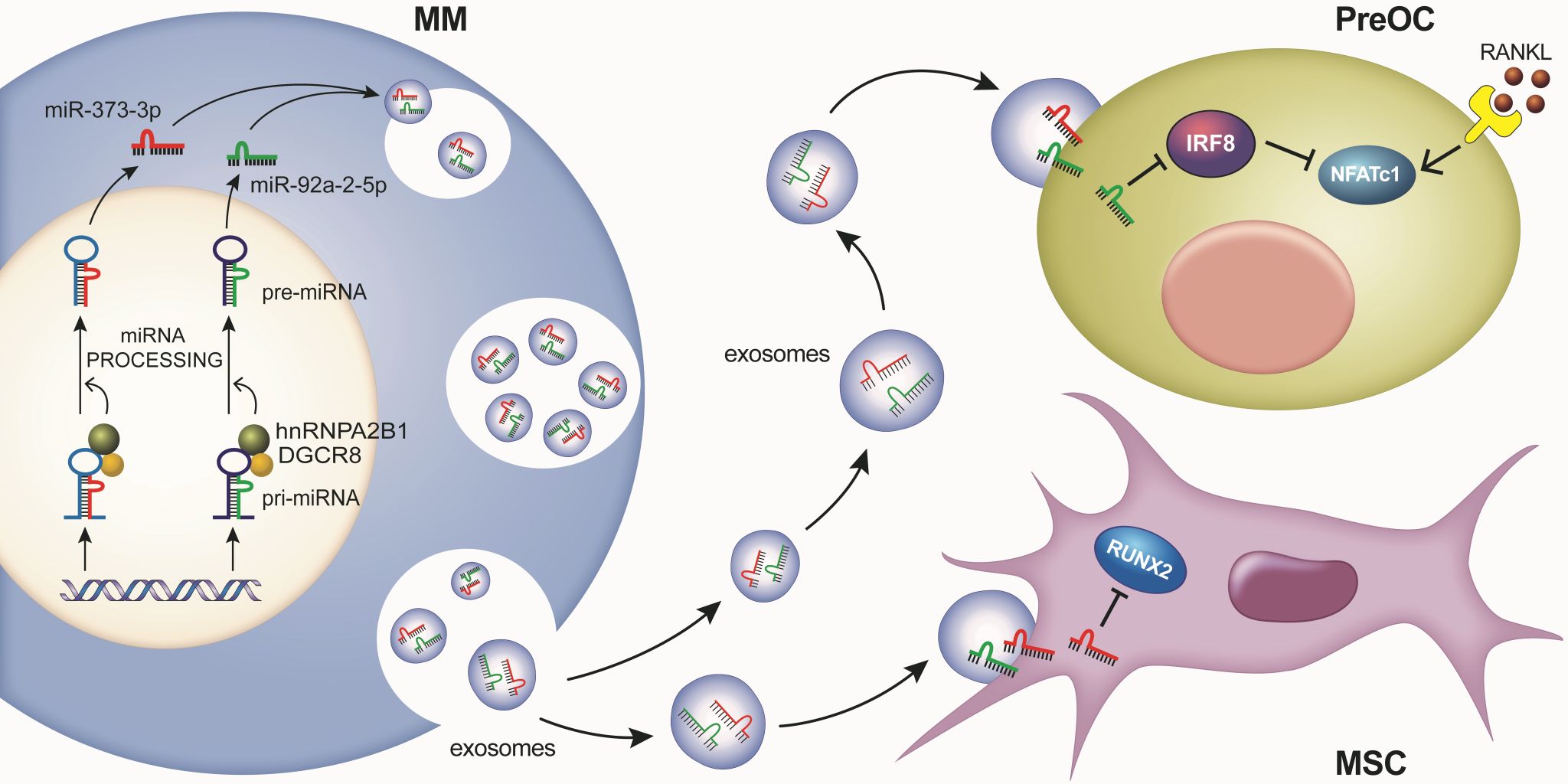
RNA甲基化修饰(N6-methyladenosine, m6A)是真核生物RNA最广泛存在的修饰类型。在本项工作中研究团队发现RNA甲基化识别蛋白异质核核糖核蛋白A2B1(hnRNPA2B1)在骨髓瘤细胞中高表达,同时在骨髓瘤患者中,有骨损伤组骨髓瘤细胞hnRNPA2B1的表达水平显著高于无骨损伤组。进一步的分子机制研究发现,骨髓瘤细胞hnRNPA2B1与DGCR8形成复合体,通过调控RNA甲基化的方式促进miRNA(miR-92a-2-5p和miR-373-3p)的加工和成熟,而成熟的miRNA被外泌体包裹进入间充质干细胞和前破骨细胞。在前破骨细胞中,miR-92a-2-5p抑制了转录因子IRF8的表达,从而解除了IRF8对NFATc1的抑制,进而促进破骨细胞分化成熟;在间充质干细胞中,miR-373-3p抑制了转录因子RUNX2的表达,从而抑制成骨细胞的分化。另外,动物实验表明m6A抑制剂或miRNA抑制剂显著抑制了骨髓瘤细胞诱导的骨损伤。以上结果表明hnRNPA2B1是治疗骨髓瘤骨损伤的一个非常有潜力的靶点。
该项研究工作得到了国家自然科学基金面上项目,福建省杰出青年基金以及厦门大学“南强青年拔尖A类人才”基金的资助,刘欢教授团队刘蕊博士为本文第一作者,刘欢教授和方志鸿副教授为本文共同通讯作者。同时该工作也得到医学院眼科研究所楚成超副教授和公共卫生学院刘刚教授的大力帮助和支持。

刘欢,教授、博导,国家高层次青年人才、“闽江学者”特聘教授、福建省杰出青年基金获得者和厦门大学“南强青年拔尖A类人才”。热忱欢迎优秀博士后加盟,同时欢迎优秀学子报考pc加拿大预测准确率刘欢教授课题组研究生。联系方式:huanliu@xmu.edu.cn。
原文链接:
https://www.thno.org/v12p7760.htm
(图文/医学院刘欢教授课题组 审核/李炜)



