近日,许韧教授课题组在揭示“Schnurri-3”这一新型促成骨靶点的临床潜能方面取得系列新进展,相关工作成果分别以题为
1.“Bone controls browning of white adipose tissue and protects from diet-induced obesity through Schnurri-3-regulated SLlT2 secretion”
2.“Schnurri-3 inhibition rescues skeletal fragility and vascular skeletal stem cell niche pathology in the OIM model of osteogenesis imperfecta”
3.“Schnurri-3 controls osteogenic fate of Adipoq-lineage progenitors in bone marrow”发表于高水平期刊《Nature Communications》、《Bone Research》和《Journal of Orthopaedic Translation》。
许韧教授前期研究 (Nature Medicine 2018; Bone Research 2020) 发现,以Schnurri-3 (SHN3)敲除所导致的高骨量小鼠不仅仅表现为骨形成速率升高,同时表现为骨H型(CD31hiEMCNhi)血管的增加。通过RNA测序分析发现,在成骨细胞中,SHN3通过抑制ERK活性来负调控血管形成因子SLIT3的转录和表达,当SHN3敲除时,成骨细胞分泌更多的SLIT3,从而促进H型血管的形成。上述工作首次提出在小鼠骨骼疾病模型中,给予局部或全身SLIT3重组蛋白时,可通过增加H型血管的形成来有效促进骨折愈合并缓解雌性更年期所导致的骨质疏松的独特策略,但对于SHN3在肥胖等代谢性疾病、成骨不全症罕见病以及骨髓间充质细胞中的调控机制还知之甚少,因此,本研究团队针对以上三个研究方向展开研究。
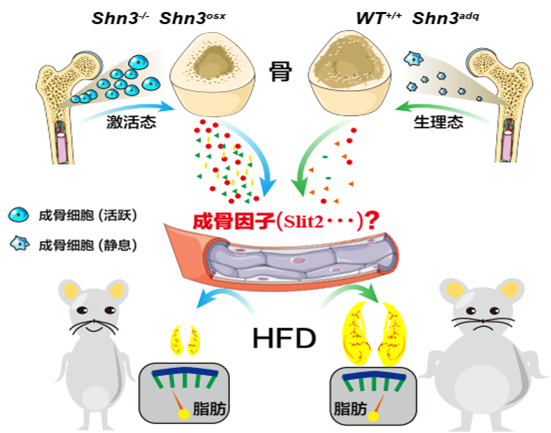
1、在发表于《Nature Communications》工作中,该研究揭示了一种由骨骼分泌的蛋白质对脂肪代谢的关键作用。这一发现为治疗肥胖症和相关代谢疾病提供了全新的视角和潜在的治疗途径。

该研究使用了Schnurri-3(SHN3)适配蛋白的高骨量小鼠模型(Shn3-/-小鼠),研究人员将Shn3-/-小鼠饲喂高脂饮食12周后,发现这些小鼠在高脂饮食(HFD)下展现出对饮食诱导肥胖的强大抵抗力,并表现出更好的葡萄糖代谢能力和更高的胰岛素敏感性。研究团队通过基因敲除小鼠模型,组织学染色,高脂饲喂代谢水平监测,RNA-seq,蛋白质组学质谱等一系列实验证实了骨骼中的成骨细胞是这一现象的关键驱动因素。该研究揭示了SHN3基因敲除后,成骨细胞可通过分泌骨源性SLIT2-C,促进白色脂肪细胞棕色化,进而发挥抵抗饮食诱导性肥胖、改善糖代谢的作用。这一发现进一步证实了骨骼不仅仅是支持身体结构的静态器官,更是活跃参与全身能量代谢的内分泌器官。该研究阐明了通过调控骨SHN3-SLIT2轴,不仅可能治疗骨质疏松症,而且有助于改善肥胖相关代谢性疾病。该研究同时针对这两种严重危害人类健康的慢性疾病,对未来开发新型治疗方法提供了重要的理论基础。
该项研究工作由许韧教授团队、中南大学湘雅医院吕红斌教授和美国康奈尔大学医学院Matthew Greenblatt 教授团队共同合作完成。中南大学湘雅医院八年制博士研究生/现浙江大学第一附属医院核医学科医师李赞,pc加拿大预测准确率博士研究生石宝弘、pc加拿大预测准确率助理研究员/博士后李娜为本文共同第一作者,许韧教授为本文最后通讯作者,Greenblatt 教授和吕红斌教授为本文共同通讯作者。该研究得到了洛克菲勒大学Paul Cohen教授课题组以及浙江大学附属第一医院苏新辉教授课题组的大力支持。
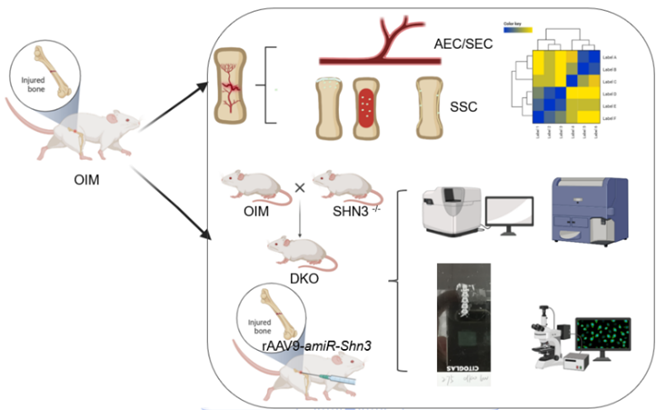
2、在发表于《Bone Research》工作中,研究团队关注骨骼发育中最为典型的一类遗传性罕见病—成骨不全症,患儿极易发生骨折,轻微的碰撞,也会造成严重的骨折,当前在临床上仍然不可治愈,急需新的治疗策略来有效应对。近年来,骨骼干细胞和骨形成特异微环境逐渐成为骨科学研究的核心内容。深度探究成骨不全症所涉及到的“新兴”细胞类群骨骼干细胞(SSC)、骨血管内皮细胞(AEC,SEC)及其相关属性的变化(更新、分化、增殖等),并确定与其关联的细胞分子基础,为未来成骨不全症的精准医学研究和细胞治疗方案打下理论基础,提供新型策略和方向。

该研究利用基因敲除小鼠模型,流式分析分选,免疫荧光染色,全骨组织清除染色,关节腔注射腺相关病毒等实验技术开展综合研究,首次揭示了成骨不全症(OIM)小鼠的骨骼干细胞以及血管内皮细胞的病理缺陷,对敲除Schnurri-3挽救OIM的低骨量、易骨折的病理特征以及改善骨骼干细胞和血管内皮细胞缺陷的作用进行了完整解析。该工作为探寻针对成骨不全症全新的药物靶点和治疗策略及揭示相关骨骼疾病的发病机理提供了重要的理论支撑,具有重要的生物学意义和潜在的临床价值。
pc加拿大预测准确率许韧教授为本文的最后通讯作者;pc加拿大预测准确率助理研究员/博士后李娜,博士研究生石宝弘为该文章共同第一作者。本项目研究得到科技部、中组部、基金委等各项国家级基金的资助;美国康奈尔大学医学院Greenblatt教授、厦门大学生科院周大旺、陈兰芬教授等课题组给予本项目大力支持。
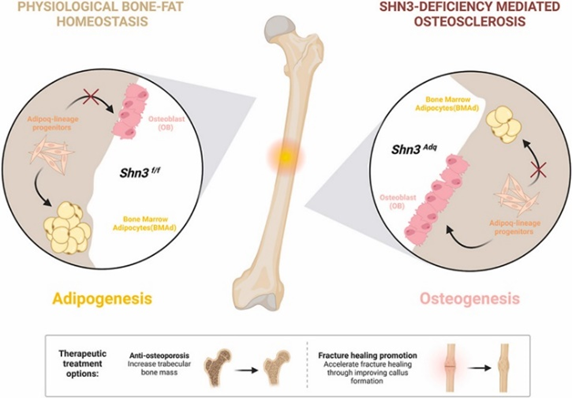
3、在发表于《Journal of Orthopaedic Translation》工作中,研究团队关注到脂联素标记的成脂谱系祖细胞(Adipoq-lineage progenitor)在骨髓中的成骨潜能已被观察到支持骨维持和修复。然而,除了Schnurri-3 (SHN3,也称为HIVEP3)对成骨细胞骨形成的负调控外,其对间充质谱系细胞中的功能知之甚少。

在这项研究中,我们使用单细胞RNA测序(scRNA-seq)分析来证明,与小鼠和人类的其他间充质细胞群体相比,adipoq谱系祖细胞表达更高水平的Shn3。adipoq谱系祖细胞中Shn3的缺失导致体内骨小梁骨量和骨形成显著增加,而不会破坏全身能量代谢和骨骼发育。小鼠谱系示踪和体外功能分析显示,Shn3消融有效地将adipoq谱系祖细胞的命运转变为骨髓的促成骨表型。此外,体内研究表明,在病理条件下,adipoq谱系祖细胞中缺乏Shn3还能促进骨折愈合。综上,研究团队通过靶向骨髓adipoq谱系祖细胞,促进其骨合成代谢潜力,从而为骨质疏松症等相关疾病提供了一种新型治疗策略。
pc加拿大预测准确率许韧教授为本文的最后通讯作者;中南大学湘雅医院八年制博士研究生/现浙江大学第一附属医院核医学科医师李赞,pc加拿大预测准确率硕士研究生曾祥晨,博士研究生石宝弘为该文章共同第一作者。美国康奈尔大学医学院Greenblatt教授、厦门大学成功医院(解放军第73集团医院)骨科黄建明主任给予本项目大力支持。
许韧教授课题组因工作需要,现公开招聘博士后,热忱欢迎生物医学领域青年才俊加盟,同时欢迎优秀学子报考硕士及博士研究生。
本论文1链接:https://www.nature.com/articles/s41467-024-51155-6
本论文2链接:https://doi.org/10.1038/s41413-024-00349-1
本论文3链接:https://doi.org/10.1016/j.jot.2024.01.008



